Analyse des biologischen Geschlechts in der Labortierforschung
Tierforschung war schon immer ein unverzichtbarer Teil von Naturwissenschaft und Medizin. Bis in die 1960er Jahre dokumentierten Wissenschaftler_innen allerdings das Geschlecht von Tieren nur selten, ausgenommen bei Versuchen im Zusammenhang mit der Reproduktion. Selbst heute bleibt das biologische Geschlecht der Tiersubjekte „in 22–42% der Artikel in Zeitschriften der Fächer Neurowissenschaften, Physiologie und interdisziplinärer Biologie unerwähnt“ (Beery & Zucker, 2011). Die Analyse von Tierstudien, in denen das Geschlecht dokumentiert wurde, zeigt, dass weibliche Tiere in den meisten Feldern außer Reproduktionsbiologie und Immunologie unterrepräsentiert sind – s. die untenstehende Grafik.
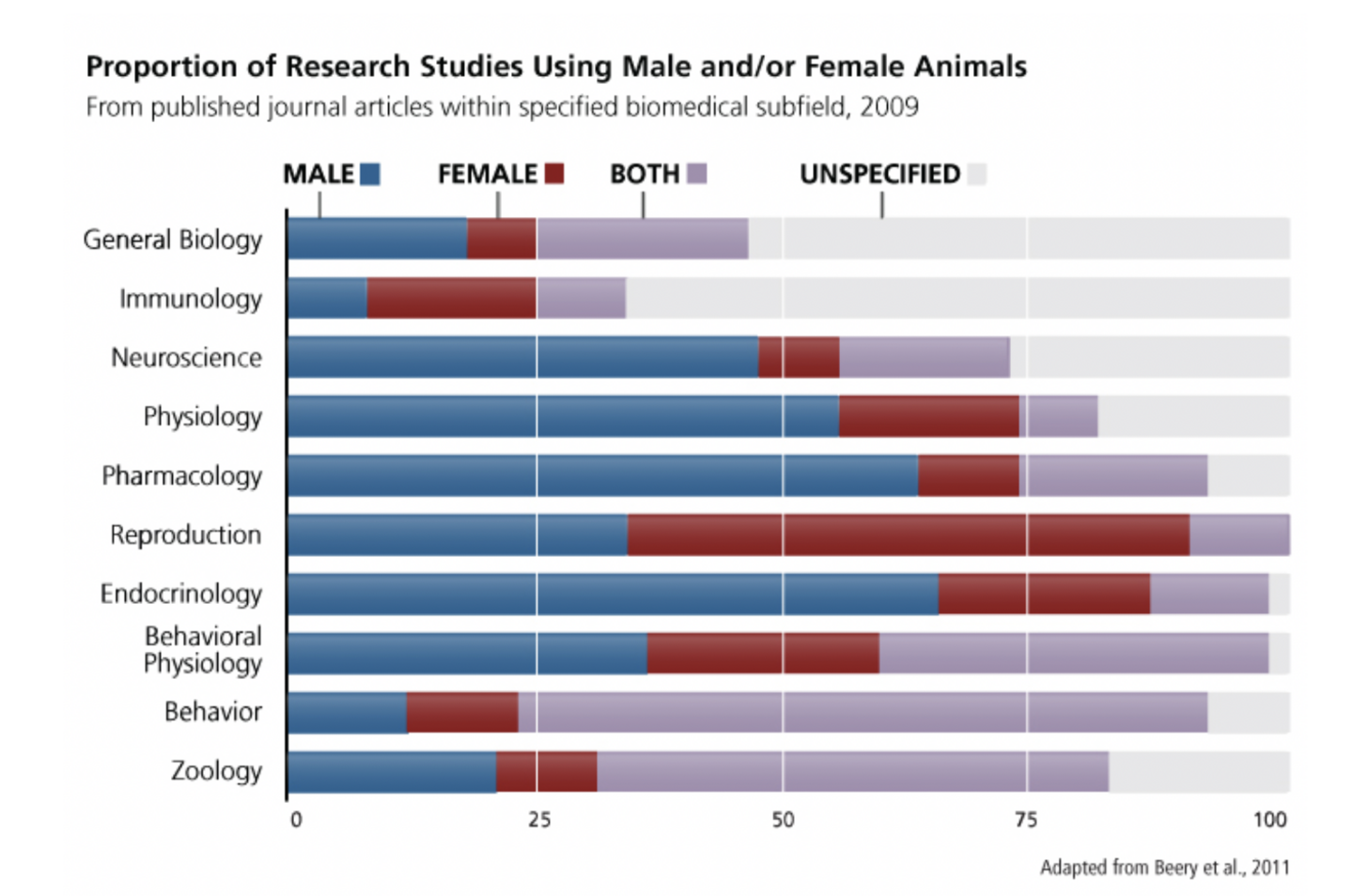
Allgemeines:
Die Unterrepräsentation von weiblichen Tieren. Eingeschlechtliche Versuche sind die einzige Möglichkeit für geschlechtsspezifische Phänomene (Eierstock- oder Prostatakarzinome etwa) und können auch nützlich sein, wenn ein Geschlecht unterberücksichtigt ist (McCarthy & Becker, 2002). Die meisten eingeschlechtlichen Tierversuche fallen allerdings nicht in diese Kategorien. Weibliche Tiere sind generell auch in Studien zu Krankheiten unterrepräsentiert, die beide Geschlechter betreffen, und auch in Forschungsfeldern, bei denen die Evidenz vermuten lässt, dass das Geschlecht die Ergebnisse beeinflusst.
Wann können Versuche mit nur einem Geschlecht durchgeführt werden?
1. Bei der Untersuchung eines geschlechtsspezifischen Phänomens wie Eierstock- oder Prostatakarzinome.
2. Um unzureichende veröffentlichte Daten über ein Geschlecht in einem bestimmten Bereich auszugleichen.
3. Wo es statistisch abgesicherte Evidenz gibt, dass das Geschlecht ein Merkmal oder Ergebnis nicht beeinflusst.
Bei Krankheiten, bei denen ein Geschlecht überwiegt, etwa Brustkrebs, kann es dennoch sein, dass beide Geschlechter inkludiert werden müssen, doch man kann entscheiden, sie nicht zu gleichen Teilen einzusetzen. Die Dinge liegen in Fällen komplizierter, wenn eine Krankheit sich bei Männern und Frauen stark unterscheidet, aber nur für ein Geschlecht ein Tiermodell entwickelt wurde. So entsprechen Nagetiermodelle für Bluthochdruck der Physiologie der Herzkrankheit bei Frauen nicht korrekt. In diesen Fällen müssen neue Modelle entwickelt werden. Es wurde deutlich, dass die Krankheitsmuster bei Frauen anders verlaufen, bei ihnen besteht weniger eine Okklusion der Koronararterien sondern vielmehr eine mikrovaskuläre Erkrankung aufgrund von Veränderungen in der mikrovaskulären Endothelfunktion (Ouyang et al., 2016; Miller et al., 2011; Methta, 2016; Regensteiner, 2015). Tiermodelle für koronare mikrovaskuläre Erkrankungen müssen entwickelt werden, auch Tiere, die potentielle Interaktionen mit schwangerschaftsbezogenen Krankheiten wie Präeklampsie oder Schwangerschaftsbluthochdruck, neurovaskuläre Fehlregulationen im Wechsel im Zusammenhang mit „Hitzewallungen“ und metabolische Erkrankungen wie Diabetes berücksichtigen.
Geschlecht und Laborumgebung in Tierstudien
Welches Design eignet sich bei Tierstudien am besten, um das biologische Geschlecht (biologische Eigenschaften) und Umweltfaktoren und -prozesse zu berücksichtigen? Die folgende Grafik zeigt die komplexe Interdependenz von Geschlecht und Umgebung, unter anderem das biologische Geschlecht des Wissenschafters/ der Wissenschafterin im gesamten Lebenszyklus von Nagetieren.
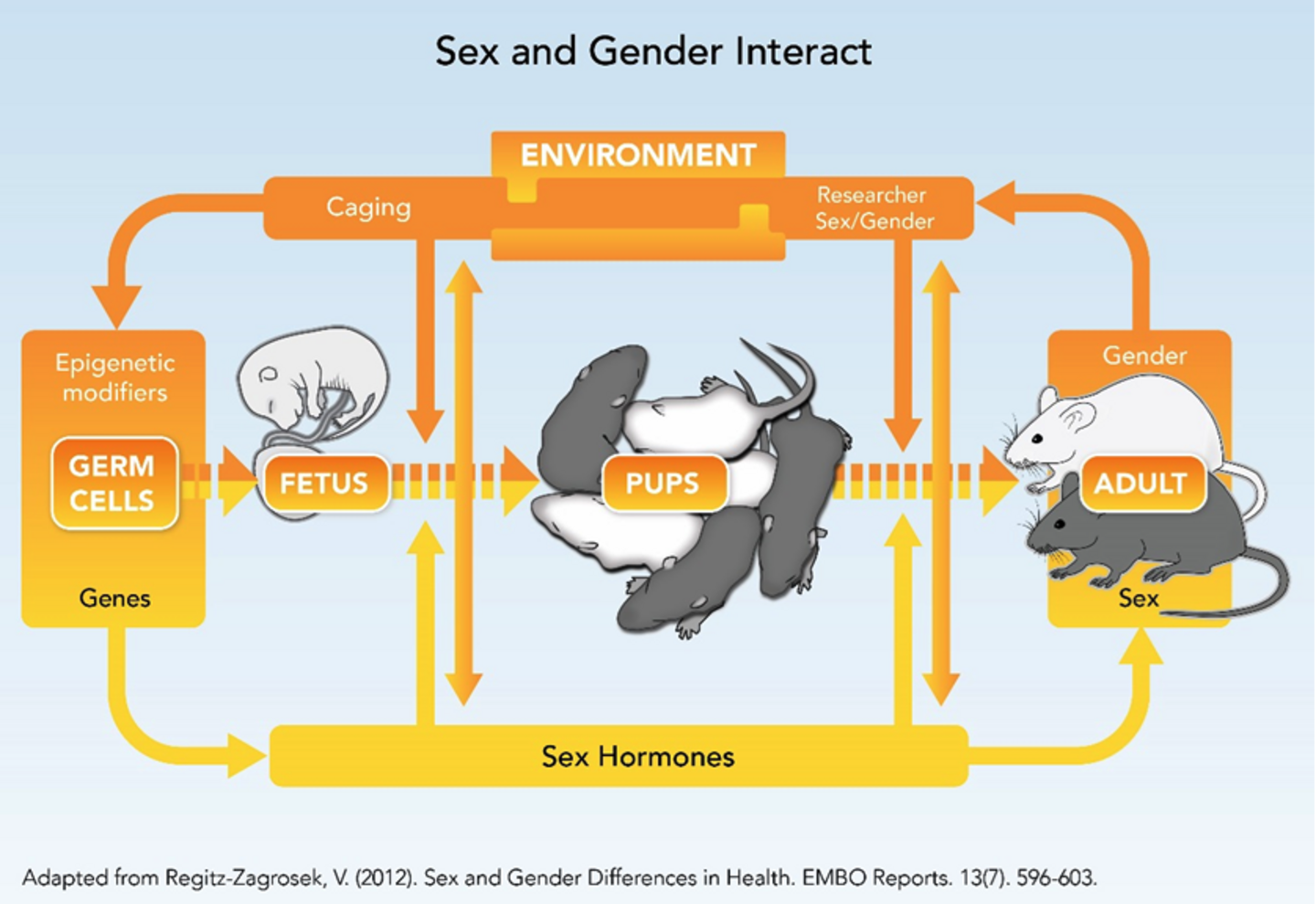
Tierforschung betrifft die Interaktion zwischen biologischem Geschlecht (biologischen Eigenschaften wie Genen, Hormonen, Alter, reproduktive Phase, Stamm etc.) und Umweltbedingungen (etwa Käfighaltung, Geschlecht von Forscher_innen, Einstellungen und Verhaltensweisen von Forscher_innen, Raumtemperatur, Futter etc.).
Forschungsdesign
A. Untersuchung der Rolle des biologischen Geschlechts
• Der Einfluss des biologischen Geschlechts muss untersucht werden, bevor er ausgeschlossen werden kann.
• Forschung kann schrittweise durchgeführt werden. Männliche und weibliche Tiere müssen hinsichtlich des Stammes (oder hinsichtlich des Stammes und des Genotyps) ebenso wie hinsichtlich des Alters abgeglichen werden und sollten unter identischen Bedingungen (Käfige, Streu, Futter etc.) gehalten werden. Weibliche Tiere sollten keine Zuchttiere sein, außer das ist für die Beurteilung des Phänotyps notwendig.
Schritt 1: Gesamtstichprobengröße (aufgrund von Trennschärfeberechnungen). Die Berücksichtigung von weiblichen und männlichen Tieren erfordert häufig, aber nicht immer, die Verdoppelung der Zahl der Versuchssubjekte. Effiziente Versuchsanordnungen können das biologische Geschlecht einbauen und gleichzeitig die Kontrolle über die Varianz behalten (Beery, 2018). Zum Beispiel erfordern faktorielle Versuchsplanungen eine Vergrößerung der Stichprobe um 14–33%, nicht um das Doppelte (Buch et al., 2019; Miller et al., 2016). Die Auswertung von Daten nach Geschlecht und Umweltfaktoren ermöglicht den Nachweis von signifikanten Effekten, was wiederum hilft, Störvariablen und die kumulative Zahl von erforderlichen Versuchen zu verringern.
Schritt 2: Geschlechtsbasiertes Powering: Testung der Hypothese bei weiblichen und männlichen Tieren und Trennschärfeberechnung von beiden Versuchen, um den Effekt zu bestimmen. Faktorielle Designs sollten erwogen werden, um die Stichprobengröße bei der Untersuchung von Interaktion zwischen biologischem Geschlecht und Behandlung bei Tieren zu verringern (Beery, 2018; Lazic, 2018).
Schritt 3: Vergleich zwischen Geschlechtern: Trennschärfeuntersuchung, um den tatsächlichen „Geschlechtseffekt“ zu bestimmen. Das Testen von Geschlechtseffekten kostet Geld. Ein bewiesener Geschlechtsunterschied rechtfertigt jedoch geschlechtsspezifische Forschung, weil schädliche Wirkungen bei einem Geschlecht für die Gesellschaft und individuelle Patient_innen kostspielig sind. Insgesamt ist es weniger teuer, das biologische Geschlecht in der Grundlagenforschungsphase zu verstehen als im Rahmen der kostenintensiveren klinischen Versuche (Klein et al., 2015). Die Analyse des biologischen Geschlechts kann die Zahl der Medikamente verringern, die in der Entwicklung versagen, und hilft Unternehmen auch zu vermeiden, dass sie Medikamente aufgrund von Nebenwirkungen bei einem Geschlecht vom Markt nehmen müssen.
• Überlappungen zwischen Gruppen (Ähnlichkeiten zwischen männlichen und weiblichen Subjekten) sowie Unterschiede innerhalb von Gruppen (Unterschiede unter männlichen oder weiblichen Subjekten) sollten evaluiert werden. Eine Überbetonung von Geschlechterunterschieden sollte vermieden werden.
• Es sollte auch berichtet werden, wenn kein Geschlechtseffekt nachgewiesen wurde. Um den Publikationsbias zu verringern, sollte auch berichtet werden, wenn keine Geschlechterunterschiede (Haupt- oder Interaktionseffekte) nachgewiesen wurden oder die Daten über Geschlechterunterschiede statistisch nicht aussagekräftig sind (Wizemann, 2012). Berichte über Nullresultate sind für Metaanalysen unerlässlich.
• Bei Phänotypen, die keine Geschlechterdifferenz zeigen, sollten künftige Versuche geschlechterinklusiv sein; das heißt, sie sollten in jeder untersuchten Testgruppe gleiche Zahlen von zufällig ausgewählten männlichen und weiblichen Tieren verwenden. Nicht jeder Versuch muss entworfen werden, um Geschlechterunterschiede zu evaluieren. Allerdings sollte bei jedem Versuch das Geschlecht der Versuchstiere berichtet werden, um die Reproduzierbarkeit von Versuchen zu gewährleisten und zu vermeiden, dass Ergebnisse (bei einem Geschlecht) übermäßig generalisiert und auf das andere Geschlecht übertragen werden (Wizemann, 2012).
• Analyse der Wirkung von Sexualhormonen
Berücksichtigung des Sexualzyklus (Byers et al., 2012). Forschungen zeigten, dass die meisten Geschlechtseffekte nicht durch den Zyklus beeinflusst werden (Becker et al., 2005). Forschungen sollten die Variabilität in weiblichen und männlichen Reaktionen vergleichen. Es ist nur notwendig, den Sexualzyklus zu überwachen, wenn die weiblichen eine stärkere Varianz aufweisen.
• In einer Metaanalyse von fast 10.000 Merkmalen zeigten Prendergast et al. (2014), dass weibliche Subjekte bei fast allen biologischen Kennzahlen eine größere Varianz aufweisen als männliche (Itoh & Arnold, 2015; Becker et al., 2016). Andere Faktoren wie Gruppenhaltung versus Einzeltierhaltung können einen größeren Einfluss auf ein Merkmal haben als die Stadien des Sexualzyklus.
Menopausenmodelle. Die Menopause ist ein relativ neuer Bereich der Labortierforschung. Nagetiere zeigen reproduktives Altern und können in der Forschung genutzt werden, um Einsichten in die Menopause bei Frauen zu gewinnen. Die reproduktive Alterung beginnt bei Ratten oder Mäusen gegen Ende des ersten Jahres und der Zeitpunkt kann je nach Stamm und Umweltfaktoren variieren (Finch et al., 1984). Im Alter von über einem Jahr zeigen weibliche Nagetiere entweder einen niedrigen Geschlechtshormonspiegel (persistenter Diöstrus) und/oder chronisch erhöhte Östrogenspiegel (persistenter Östrus) (Finch et al., 1984). Der persistente Östrus führt irgendwann zum Diöstrus, es kann aber je nach Gattung eine Zwischenphase mit Scheinträchtigkeit geben (Finch et al., 1984). Ovarektomie kann reproduktive Alterung simulieren, indem die Sexualhormonspiegel rasch gesenkt werden, und diese „akute Menopause“ hat eine Vielzahl von Auswirkungen. Ein zunehmend interessantes Gebiet sind die Auswirkungen der Menopause auf das Immunsystem. Bei Nagetieren löst Ovarektomie „reduzierte Lymphknoten-Chemotaxis, mitogengesteuerte T-Zell-Proliferationsreaktionen und [Interleukin-2] Produktion“ aus (Marriott & Huet-Hudson, 2006).
Trächtigkeit oder Scheinträchtigkeit. Bei nicht einmal 10% der seit 1980 von der US-Behörde für Lebens- und Arzneimittel (FDA) zugelassenen Medikamente gibt es ausreichende Information über das Risiko von Geburtsschäden (Adam et al., 2011; Mishra & Mohanty, 2010). Neue Tierforschungen über Medikamentensicherheit sollten Auswirkungen auf das Muttertier und den Fötus während Trächtigkeit und Laktation untersuchen (McDonnell-Dowling & Kelly, 2015).
Pharmakokinese. Der Sexualzyklus kann auch die Pharmakokinetik beeinflussen. Kulkarni et al. (2012) zeigten etwa, dass die orale Bioverfügbarkeit von Genistein, einem Soja-Isoflavon mit antioxidanten Eigenschaften, im umgekehrten Verhältnis zum Östrogenspiegel (der die Verteilung über die Leber reguliert) steht.
B. Untersuchung der Interaktion der Umgebung mit dem biologischen Geschlecht
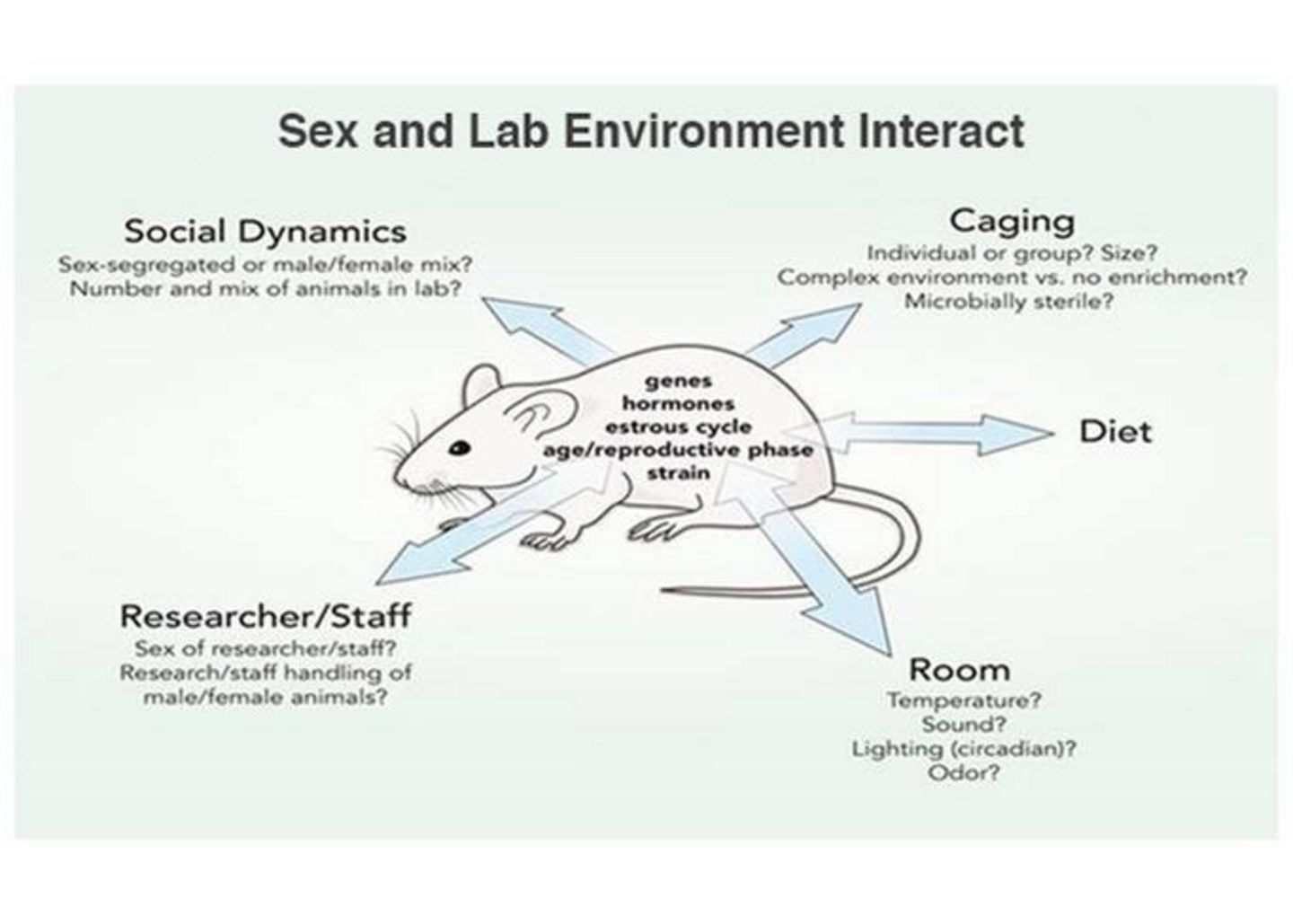
Tierforschung umfasst die Interaktion zwischen biologischen Geschlecht (biologischen Eigenschaften wie Genen, Hormonen, Alter, reproduktiver Phase, Stamm etc.) und Laborumgebung (z. B. Käfighaltung, Einstellungen und Verhaltensweisen der Forschenden, Raumtemperatur, Futter etc.). Die beidseitigen Pfeile stellen Interaktionen zwischen biologischem Geschlecht und Umwelt dar. Umweltprozesse wie Käfighaltung oder unterschiedliche Behandlung können sich auf weibliche und männliche Tiere unterschiedlich auswirken. Effekte sollten nicht als vom Geschlecht (oder einem biologischen Merkmal) abhängig bestimmt werden, wenn sie tatsächlich von Umweltbedingungen abhängen.
Umweltprozesse, die mit dem biologischen Geschlecht interagieren können:
Käfighaltung: Einzeltier vs. Gruppe?
- Zur Vermeidung von aggressivem Verhalten werden männliche Nagetiere häufig in Kleingruppen oder alleine gehalten. Nagetiere, die alleine gehalten werden, „verbrauchen mehr Energie zur Aufrechterhaltung der Körpertemperatur, was Unterschiede in Parametern wie Kalorienaufnahme, Muskelaktivität, Umsatz, Fettverteilung oder Körpergröße verursachen kann, mit einer Vielzahl von möglichen Folgeeffekten auf die körperliche und zelluläre Aktivität“ (Ritz et al., 2014). Im Gegensatz dazu werden weibliche Tiere öfter gemeinsam gehalten, um Kosten zu senken. Gemeinsam gehaltene Nagetiere schlafen oft zusammengedrängt und verbrauchen daher weniger Energie, um sich warm zu halten. In diesem Szenario könnte ein „Geschlechtsunterschied“ identifiziert werden, wo die Unterschiede tatsächlich aus unterschiedlichen Haltungsbedingungen resultieren.
- Eine gleich große Gruppe kann bei weiblichen und männlichen Tieren unterschiedliche Stressfaktoren auslösen. Einzelkäfighaltung kann in sich Stress verursachen (Ritz et al., 2014), doch Einzelhaltung verringert die Merkmalvariabilität sowohl bei weiblichen als auch bei männlichen Tieren (Prendergast et al., 2014).
- Käfighaltung in Gruppen kann auch zu selbstverursachtem oder sozialem Fellverlust führen (Kaleuff et al., 2006). Barbering (1) spiegelt häufig soziale Hierarchien in (sowohl weiblichen als auch männlichen) gleichgeschlechtlichen Käfiggruppen wider; (2) kann durch den Überbelegungsstress verursacht werden; (3) kommt in Zuchtgruppen vor (Weibchen gegenüber Männchen); und (4) kommt bei laktierenden Nagetieren vor (Jungtiere gegenüber Muttertieren). Barbering kommt bei manchen Stämmen häufiger vor als bei anderen.
- Die Käfiggröße kann das Verhalten des Tieres einschränken. Zum Beispiel ist in vielen Käfigen die ganze Bandbreite von weiblichem Sexualverhalten aus Platzgründen nicht möglich. In freier Wildbahn können Weibchen huschen, sich annähern und um Männchen werben (Birke, 2011). Aus diesen Gründen sollten in Artikeln die Haltungsbedingungen präzisiert werden.
Forschende/Personal. Die Versuchsleitung kann in der Nagetierforschung eine Störvariable darstellen, wo Stress ein signifikanter Faktor ist. Eine Studie zeigte, dass Ratten und Mäuse in Gegenwart eines männlichen Expterimentators im Vergleich zu Frauen eine verminderte Schmerzreaktion zeigten. Sowohl männliche als auch weibliche Nagetiere zeigten diese Reaktion, weibliche jedoch stärker. Die Forschenden identifizierten diesen „männlichen Beobachtereffekt“ als Stressreaktion auf Androstenon und Androstadienon, Achselsekrete, die bei Männern in höherer Konzentration als bei Frauen vorkommen. Zusätzlich zur stressinduzierten Analgesie führte die Anwesenheit dieser Verbindungen zu höheren Kortikosteronspiegeln im Plasma (Sorge et al., 2014).
Behandlung. Kontrollnagetiere sollten ähnlich stressreichen Verfahren unterworfen werden wie jene der Versuchsgruppe, etwa Scheinoperationen. Die Abnahme von Vaginalabstrichen zur Feststellung der Zyklusphase bei weiblichen Nagetieren kann Stress verursachen; männliche Nagetiere sollten ähnlichen Behandlungen unterzogen werden (Becker et al., 2005). Ohne diese Kontrollmechanismen können unterschiedliche Stressreaktionen als weitere Geschlechterunterschiede fehlinterpretiert werden.
Tagesrhythmus. Testosteron variiert saisonal und in Tagesrhythmen. Ähnlich können Hormonkonzentrationen bei Weibchen im Lauf eines Tages des Sexualzyklus fluktuieren. Hypothalamus-Hypophysen-Nebennierenrinden (HPA)-Sekrete, die wiederum die Geschlechtssekretion beeinflussen, variieren ebenfalls im Lauf eines Tages (Becker et al., 2005). In Forschungsberichten sollte die Lichtperiode in der Kolonie und die Tageszeit genannt werden, zu der Messungen abgenommen werden.
Soziale Dynamik. Edelmann et al. (2013) zeigten, dass das Verhalten von Mutterratten die Geschlechterunterschiede beim Spiel von Jungtieren vermittelt. Simulierte mütterliche Fellpflege zusätzlich zu normaler mütterlicher Pflege reduzierte das Spielverhalten bei Männchen, nicht aber bei Weibchen. Dieser Effekt könnte durch vermehrte Serotoninsignale vermittelt sein, da mütterliches Lecken auch den Serotoninrezepter mRNA erhöhte.
Temperatur. Labormäuse werden üblicherweise bei Temperaturen unter ihrer thermoneutralen Zone gehalten. Gaskill et al. (2009) zeigten, dass, wenn sich Mäuse zwischen drei Käfigen mit unterschiedlichen Temperaturen frei bewegen konnten, beide Geschlechter für inaktives und Pflegeverhalten wärmere Käfige bevorzugten (und keine Bevorzugung bei aktivem Verhalten zeigten). Weibchen zogen die höchste Temperatur vor; Männchen zeigten keine Präferenz zwischen der mittleren und der höchsten Temperatur. Ebenso wie bei der Tageslänge sollten Umgebungstemperaturen in der Forschungskolonie durchwegs berichtet werden.
Futter. Ernährung wirkt sich auf Gewicht, Umsatz, Hormonspiegel und Immunfunktionen aus; daher sollte die Futterzubereitung berichtet werden (Bhupathy et al., 2010; Luczak et al., 2011). Glover & Assinder (2006) zeigten, dass phytoöstrogenreiche Ernährung geschlechtsspezifische Auswirkungen auf die Herzgesundheit haben könnte. Bei Männchen reduzierte sojareiche Ernährung die Herzfunktion signifikant, erhöhte die myozelluläre Unordnung und führte zu einer Erhöhung von β-MyHC, einem Myosin-Motorprotein, das mit Herzversagen assoziiert wird. Der letztgenannte Effekt wurde in geringerem Grad bei Weibchen beobachtet.
Streu. Die Streu könnte auch einen Einfluss auf den Hormonstatus haben. Von Maisstreu wurde berichtet, dass sie aggressives Verhalten im Vergleich zu kartonbasierter Einstreu reduziert, indem sie die Expression des Östrogenrezeptors Alpha im Gehirn beeinflusst (Landeros et al., 2012). Erhöhte Spiegel von nicht-östrogenen Mitogenen wurden ebenfalls bei Mäusen berichtet, die auf Maiskolbenstreu gehalten wurden (Markaverich et al., 2002).
Die Analyse von biologischem Geschlecht und Umgebung – und ihrer Interaktion – ist wichtig, um den Übertragungswert von Tiermodellen zu erhöhen. Die Kosten der Medikamentenentwicklung liegen zwischen 350 Millionen und 5 Milliarden US-Dollar – die durchschnittlichen Kosten werden zwischen 2 und 3 Milliarden geschätzt; 95% der Medikamentenkandidaten fallen durch (DiMasi et al., 2016; Arrowsmith, 2011; Herper, 2013). Unter anderem die Berücksichtigung von biologischem und sozialem Geschlecht als Forschungsvariablen kann diese Kosten verringern, die Entdeckung von Krankheitsmechanismen fördern und Leben retten.
Relevante Fallstudien
Tierforschung/Animal Research , öffnet eine externe URL in einem neuen Fenster
Adam, M., Polifka, J., & Friedman, J. (2011). Evolving knowledge of the teratogenicity of medications in human pregnancy. American Journal of Medical Genetics, Part C., 157, 175-182.
Arrowsmith, J. (2011). Trial watch: phase ii failures: 2008–2010. Nature Reviews Drug Discovery, 10, 328-329.
Becker, J. B., Prendergast, B. J., & Liang, J. W. (2016). Female rats are not more variable than male rats: a meta-analysis of neuroscience studies. Biology of sex differences, 7(1), 34.
Beery, A. K. (2018). Inclusion of females does not increase variability in rodent research studies. Current Opinion in Behavioral Science, 23, 143–149.
Beery, A., & Zucker, I. (2011). Sex bias in neuroscience and biomedical research. Neuroscience and Biobehavioral Reviews, 35(3), 565-572.
Buch, T., Moos, K., Ferreira, F. M., Fröhlich, H., Gebhard, C., & Tresch, A. (2019). Benefits of a factorial design focusing on inclusion of female and male animals in one experiment. Journal of Molecular Medicine, 97(6), 871-877.
Bhupathy, P., Haines, C., & Leinwand, L. (2010). Influence of sex hormones and phytoestrogens on heart disease in men and women. Women's Health 6(1), 77–95.
Birke, L. (2011). Telling the rat what to do: laboratory animals, science, and gender. In Fisher, J. A. (Ed.), Gender and the Science of Difference; Cultural Politics of Contemporary Science and Medicine (pp. 91-107). New Brunswick: Rutgers University Press.
Byers, S., Wiles, M., Dunn, S., & Taft, A. (2012). Mouse estrous cycle identification tool and images. PLoS ONE, 7(4). doi:10.1371/journal.pone.0035538.
DiMasi, J. A., Grabowski, H. G., & Hansen, R. W. (2016). Innovation in the pharmaceutical industry: new estimates of R&D costs. Journal of Health Economics, 47, 20–33.
Edelmann, M. N., Demers, C. H., & Auger, A. P. (2013). Maternal touch moderates sex differences in juvenile social play behavior. PLoS ONE, 8(2). doi:10.1371/journal.pone.0057396
Finch, C. E., Felicio, L. S., Mobbs, C. V., & Nelson, J. F. (1984). Ovarian and steroidal influences on neuroendocrine aging processes in female rodents. Endocrine Reviews, 5(4) 467-497.
Gaskill, B. N., Rohr, S. A., Pajor, E. A., Lucas, J. R., & Garner, J. P. (2009). Some like it hot: mouse temperature preferences in laboratory housing. Applied Animal Behavioral Science, 116, 279-285.
Glover A., & Assinder S. J. (2006). Acute exposure of adult male rats to dietary phytoestrogens reduces fecundity and alters epididymal steroid hormone receptor expression. Journal of Endocrinology, 189(3), 565-573.
Herper, M. (2013, August 11). The cost of creating a new drug now $5 billion, pushing big pharma to change. Forbes.
Itoh, Y., & Arnold, A. P. (2015). Are females more variable than males in gene expression? Meta-analysis of microarray datasets. Biology of Sex Differences, 6(1), 18.
Kaleuff, A., Minasyan, A., Keisala, T., Shah, Z., & Tuohimaa, P. (2006). Hair barbering in mice: implications for neurobehavioral research. Behavioral Processes, 71(1), 8-15.
Klein, S. L., Schiebinger, L., Stefanick, M. L., Cahill, L., Danska, J., De Vries, G. J., ... & Zucker, I. (2015). Opinion: sex inclusion in basic research drives discovery. Proceedings of the National Academy of Sciences, 112(17), 5257-5258.
Kulkarni K. H., Yang, Z., Niu, T, & Hu, M. (2012). Effects of estrogen and estrus cycle on pharmacokinetics, absorption, and disposition of genistein in female Sprague-Dawley rats. Journal of Agricultural and Food Chemistry, 60, 7949-7956.
Landeros, R. V., Morisseau, C., Yoo, H. J., Fu, S. H., Hammock, B. D., & Trainor, B. C. (2012). Corncob bedding alters the effects of estrogens on aggressive behavior and reduces estrogen receptor-α expression in the brain. Endocrinology, 153(2), 949-953.
Lazic, S. E. (2018). Four simple ways to increase power without increasing the sample size. Laboratory animals, 52(6), 621-629.
Luczak, E. D., Barthel, K. K., Stauffer, B. L., Konhilas, J. P., Cheung, T. H., & Leinwand, L. A. (2011). Remodeling the cardiac transcriptional landscape with diet. Physiological genomics, 43(12), 772-780.
Markaverich, B., Mani, S., Alejandro, M. A., Mitchell, A., Markaverich, D., Brown, T., ... & Faith, R. (2002). A novel endocrine-disrupting agent in corn with mitogenic activity in human breast and prostatic cancer cells. Environmental health perspectives, 110(2), 169-177.
Marriott, I., & Huet-Hudson, Y. (2006). Sexual dimorphism in innate immune responses to infectious organisms. Immunologic Research, 34(3), 177-192.
McCarthy, M., & Becker, J. (2002). Neuroendocrinology of sexual behavior in the female. In Becker, J., Breedlove, S., Crews, D., & McCarthy, M. (Eds.), Behavioral Endocrinology (pp. 124-132). Cambridge: MIT Press.
McDonnell-Dowling, K., & Kelly, J. (2015). Sources of variation in the design of preclinical studies assessing the effects of amphetamine-type stimulants in pregnancy and lactation. Behavioural Brain Research, 279, 87-99.
Mehta, L. S., Beckie, T. M., DeVon, H. A., Grines, C. L., Krumholz, H. M., Johnson, M. N., ... & Wenger, N. K. (2016). Acute myocardial infarction in women: a scientific statement from the American Heart Association. Circulation, 133(9), 916-947.
Miller, L. R., Marks, C., Becker, J. B., Hurn, P. D., Chen, W. J., Woodruff, T., ... & Makris, S. (2016). Considering sex as a biological variable in preclinical research. The FASEB Journal, 31(1), 29-34.
Miller, V. M., Kaplan, J. R., Schork, N. J., Ouyang, P., Berga, S. L., Wenger, N. K., ... & Taylor, D. A. (2011). Strategies and methods to study sex differences in cardiovascular structure and function: a guide for basic scientists. Biology of Sex Differences, 2(1). doi: 10.1186/2042-6410-2-14
Mishra, A. & Mohanty, B. (2010). Effect of lactational exposure of olanzapine on body weight of mice: a comparative study on neonates of both the sexes during post-natal development, Journal of Psychopharmacology, 23(7), 1089-1096.
Ouyang, P., Wenger, N. K., Taylor, D., Rich-Edwards, J. W., Steiner, M., Shaw, L. J., ... & Merz, N. B. (2016). Strategies and methods to study female-specific cardiovascular health and disease: a guide for clinical scientists. Biology of Sex Differences, 7(1), 19.
Prendergast, B. J., Onishi, K. G. & Zucker, I. (2014). Female mice liberated for inclusion in neuroscience and biomedical research. Neuroscience and Biobehavioral Reviews, 40, 1–5.
Regensteiner, J. G., Golden, S., Huebschmann, A. G., Barrett-Connor, E., Chang, A. Y., Chyun, D., ... & Reusch, J. E. (2015). Sex differences in the cardiovascular consequences of diabetes mellitus: a scientific statement from the American Heart Association. Circulation, 132(25), 2424-2447.
Ritz, S., Antle, D., Côté, J., Deroy, K., Fraleigh, N., Messing, K., Parent, L., St-Pierre, J., Vaillancourt C., & Mergler, D. (2014). First steps for integrating sex and gender considerations into basic experimental biomedical research. The FASEB Journal, 28(1), 4-13. doi: 10.1096/fj.13-233395.
Sorge, R., Martin, L., Isbester, K., Sotocinal, S., Rosen, S., Tuttle, A., Wieskopf, J., Acland, E., Dokova, A., Kadoura, B., Leger, P., Mapplebeck, J., McPhail, M., Delaney, A., Wigerblad, G., Schumann, A., Quinn, T., Frasnelli, J., Svensson, C, Sternberg, W., & Mogil, J. (2014). Olfactory exposure to males, including men, causes stress and related analgesia in rodents. Nature Methods, 11, 629–632.
Wizemann, T. (Ed.) (2012). Sex-Specific Reporting of Scientific Research: A Workshop Summary. Washington, D.C.: National Academies Press.