Die Membran einer Zelle besteht aus einer Lipid-Doppelschicht. Lipide sind gute chemische und elektrische Isolatoren, die Zellinneres von Zelläußerem ideal separieren können. Membranen beherbergen aber auch eine Vielzahl von Proteinen, von denen einige den geregelten Austausch von Substanzen über die Membran hinweg regulieren. Die meisten Proteine können sich innerhalb der Lipidschichten frei bewegen, sind aber erstaunlicherweise oft in Gruppen anzutreffen. Dabei kann die Bindung von Proteinen aneinander starr und dauerhaft sein; oder Proteinmoleküle treffen sich, trennen sich und fügen sich in anderer Konstellation wieder zusammen. Das Forschungsinteresse der an der Studie beteiligten Gruppen von Prof. Gerhard Schütz vom Institut für Angewandte Physik der TU Wien und von Prof. Harald Sitte vom Institut für Pharmakologie der MedUni Wien liegt darin, wie solche Interaktionen funktionieren, was weiteren Aufschluss über die Funktionsweise der Zellmembran und der in ihnen eingebetteten Membranproteine geben könnte.
Moleküle zählen durch Licht
Proteinmoleküle sind wegen ihrer Größe nicht mit freiem Auge beobachtbar, weshalb man ihnen mit dem Mikroskop folgen muss. Allerdings ist die Herausforderung dabei, genau jene Proteine, die für die jeweilige Fragestellung interessant sind, aus einer großen Anzahl an anderen Proteinen einer Zelle herauszufiltern. "Gemeinsam mit Prof. Harald Sitte von der Medizinischen Universität Wien interessiert uns derzeit besonders der Serotonin-Transporter (SERT), ein Protein, das für die Aufnahme des Neurotransmitters Serotonin im Gehirn wichtig ist. Um es unter dem Mikroskop beobachten zu können, wird es mit Hilfe eines fluoreszierenden Biomoleküls, eines ‚green fluorenscent protein‘ (GFP), markiert", erklärt Prof. Schütz. Dabei wird das GFP molekularbiologisch mit dem SERT verknüpft, wie ein farbiger Luftballon. "Durch die Methode der ‘Single Molecule Microscopy‘ können wir aus der Signalstärke der beobachteten Lichtpunkte feststellen, ob sich das betreffende Molekül allein oder mit einem anderen Molekül seiner Art bewegt."
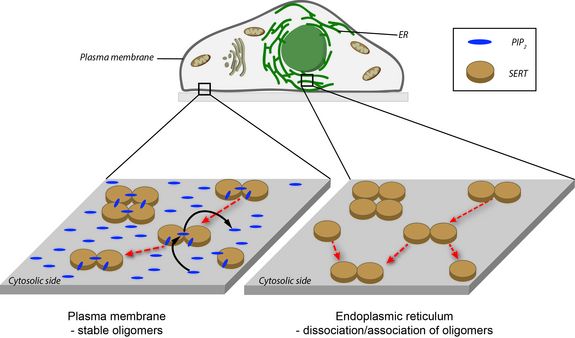
Als Biophysiker interessiert Schütz nicht nur, dass sich die Proteine gemeinsam bewegen, sondern auch warum die beiden Moleküle zusammenkleben, also wie die zugrunde liegenden Interaktionsmechanismen funktionieren. Ein zentrales Signalmolekül ist PIP2 (Phosphatidylinositol-4,5-bisphosphat), das überwiegend auf der dem Zellinneren zugewandten Zellmembran-Seite vorkommt. Es dockt perfekt an den SERT an, mit erstaunlichen Konsequenzen. Ist nur eine niedrige Konzentration an PiIP2 verfügbar, so verhält sich die Oligomerisierung des SERT wie erwartet: niedrige SERT-Konzentrationen ergeben vor allem Monomere, hohe Konzentrationen führen zur Formierung von Oligomeren. „Nicht nur, dass wir eine große Anzahl an Oligomeren sehen, wir wissen auch, dass sie gegenseitig Moleküle austauschen“, beschreibt Schütz seine Forschungsarbeit. Ist jedoch das Angebot an PIP2 hoch, so bilden sich im Mittel immer gleich große Oligomere aus, unabhängig von der SERT-Konzentration. „Es ist, als ob die SERT-Proteine in einer voreingestellten Anordnung arretiert wären.“
Der Clusterbildung auf der Spur
Um den Mechanismen dieser erstaunlichen Oligomerbildung auf die Spur zu kommen, muss man ins Innere der Zelle vorstoßen. Ein Zellbereich namens Endoplasmatisches Reticulum fungiert als jener Ort, an dem alle Membranproteine – also auch SERT – hergestellt werden. Es ist de facto PIP2-frei, dort sollte SERT also unterschiedliche Oligomerisierungsgrade aufweisen, je nach SERT- Konzentration. Das wurde auch in der Tat beobachtet. "Wir vermuten, dass SERT nach seiner Herstellung im Endoplasmatischen Reticulum oligomerisiert, dieser Prozess zunächst aber reversibel ist. Erst wenn das Protein an der Zellmembran ankommt, wird der voreingestellte Oligomerisierungsgrad durch PIP2 arretiert", sagt Schütz. "Die Beobachtungen werden durch gezielte Änderungen der Proteinstruktur bestätigt, die wir am Serotonin-Transporter eingefügt haben", so Sitte. "Die Position der Punktmutationen konnten wir durch Computermodelle sehr gut bestimmen, die Dr. Thomas Stockner im Rahmen dieser Studie erstellt hat. Die mutierten SERT-Moleküle zeigen ein Verhalten, das die Arretierung nahezu komplett verhindert. Und die medizinische Relevanz unserer Beobachtung liegt in der Bedeutung der Oligomerisierung für die Wirkweise verschiedener Psychostimulantien, wie z.B. der Amphetamine: diese können nur dann wirken, wenn ausreichend miteinander verbundene SERT-Moleküle in der Membran vorgefunden werden."
Diese Studie entstand im Rahmen des vom Fond zur Förderung von Wissenschaft und Forschung (FWF) geförderten Spezialforschungsbereichs F35 "Transmembrane Transporters in Health and Disease", der vor allem Wissenschaftler_innen der Medizinischen Universität Wien umfasst. Koautor der Studie und Sprecher des SFB ist Pharmakologe Harald Sitte, der sich seit vielen Jahren mit der Funktionsweise von SERT und anderen Transporterproteinen, sowie deren Modulation durch Psychopharmaka interessiert.
Originalpublikation:
Anderluh, A. et al.
Direct PIP2 binding mediates stable oligomer formation of the serotonin transporter.
Nat. Commun. 7, 14089 | DOI: 10.1038/ncomms14089 (2016)
Bilderdownload, öffnet eine externe URL in einem neuen Fenster
Rückfragehinweise:
Univ.Prof. Dipl.-Ing. Dr.
Gerhard Schütz
Technische Universität Wien
Institut für Angewandte Physik
Getreidemarkt 9, 1060 Wien
T: +43-1-58801-13480
gerhard.schuetz@tuwien.ac.at
Univ.Prof. Dr. Harald Sitte
Medizinische Universität Wien
Zentrum für Physiologie
und Pharmakologie
Institut für Pharmakologie
Währingerstraße 13a, 1040 Wien
T: +43-1-40160-31323
harald.sitte@meduniwien.ac.at
Aussender:
Büro für Öffentlichkeitsarbeit
Technische Universität Wien
Resselgasse 3, Stiege 2, 2. Stock, 1040 Wien
T: +43-1-58801-41024
pr@tuwien.ac.at
TU Wien - Mitglied der TU Austria
www.tuaustria.at, öffnet eine externe URL in einem neuen Fenster
Flashmob der Moleküle
Neurotransmitter-Transporter gehören zu den begehrtesten Transportproteinen in der Forschung, kommt ihnen doch eine zentrale Rolle in der Signalverarbeitung im Gehirn zu. Eine gemeinsame Studie der TU Wien und der Medizinischen Universität Wien konnte nun erstmals zeigen, welchen strukturellen Einfluss Membranlipide auf den medizinisch relevanten Serotonin-Transporter haben.
1 von 2 Bildern oder Videos
Hohe PIP2 Konzentrationen an der Zellmembran (links) verhindern SERT Oligomerisierung oder Dissoziation, sodass der Oligomerisierungsgrad arretiert wird. Im Endoplasmatischen reticulum ist die PIP2 Konzentration sehr gering (rechts), sodass die SERT-Oligomerisierung einem Gleichgewicht zustrebt.

© TU Wien
1 von 2 Bildern oder Videos
Prof. Gerhard Schütz