Vision und Grundgedanke
Die Entwicklung und Bereitstellung von Methoden und Werkzeugen mit denen ein mechanistisches Verständnis der mechanischen Eigenschaften biologischer Gewebe erlangt werden kann. In weiterer Folge sollen diese Methoden und Werkzeuge angewandt werden um Veränderungen Alterung und Krankheit zu ermitteln und somit neue Wege für die Diagnose und Therapie für Patienten bereitzustellen.
Labor, Kompetenzen und Methoden
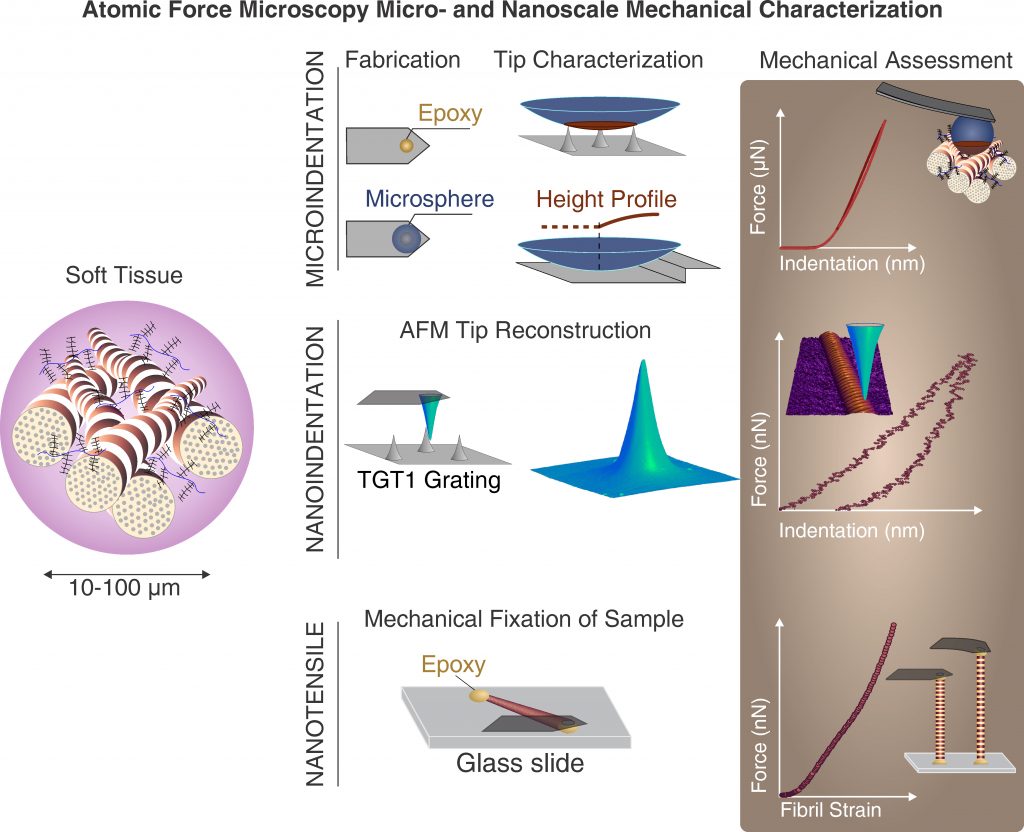
Unsere experimentelle Studien werden im Interfakultären Labor für Micro- und Nanomechanik von biologischen und biomimetischen Materialien (MMLab) durchgeführt. Das MMLab (welches unter der Leitung des ILSB steht) bietet über Kooperationsvereinbarungen Zugang zu allen experimentellen Einrichtung. Unsere Kompetenzen und Methoden beinhalten: Rasterkraftmikroskopie, Nanoindentation, Micro-Computer Tomografie, Lichtmikroskopie, Mikromechanische Charakterisierung, Instrumentierung, Präparation von Gewebeproben und mehr.
Gewebebiomechanik auf mehreren Längenskalen
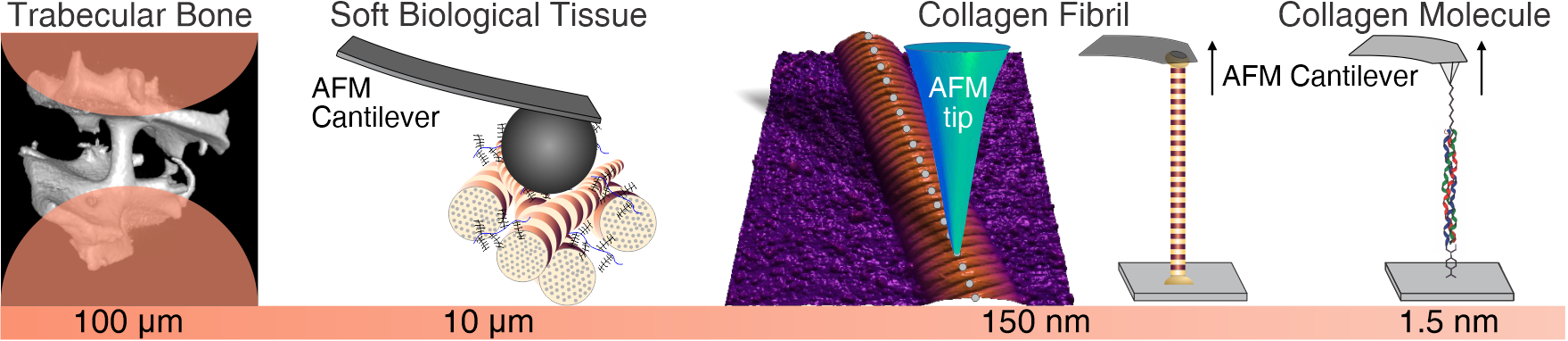
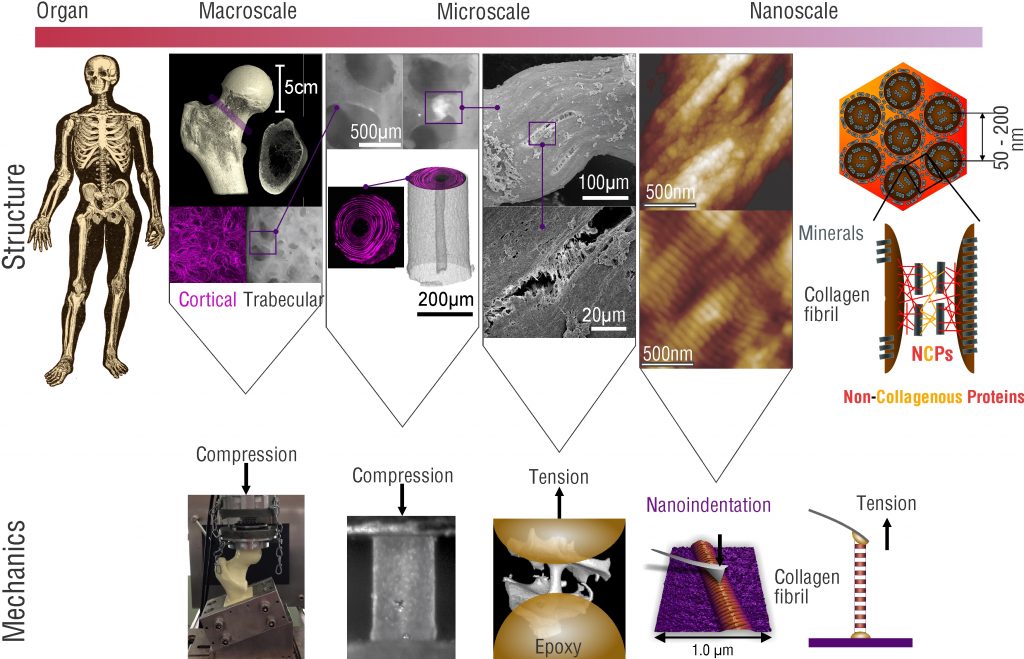
Gewebe sind von Natur aus hierarchisch aufgebaute Verbundmaterialien, die aus nanoskaligen Bausteinen bestehen. Der Grund für die nanoskalige Größe der Bausteine liegt in der begrenzten Fähigkeit biologischer Zellen, große monolithische Strukturen aufzubauen. Daher besteht die Strategie lebender makroskopischer Systeme, z.B. dem menschlichen Körper, darin hierarchische Strukturen und Architekturen zu verwenden. Innerhalb dieser Strukturen bilden die jeweils kleineren Bausteine größere Strukturelemente, die schließlich zu ganzen Organen und in Kombination zu einem kompletten lebenden System führen. Diese intelligente Art und Weise, „Riesen aus Zwergen“ zu erschaffen, hat jedoch komplexe Auswirkungen auf die Biomechanik lebender Systeme, vor allem auf die enthaltenen Gewebe.
Erstens wird die Definition von Materialeigenschaften, die in der Materialwissenschaft allgemein verwendet wird, um mechanische Eigenschaften auf Materialebene im kontinuierlichen Sinne zu definieren, zu einer komplizierten Aufgabe. Gewebe an sich verhalten sich entsprechend der darin enthaltenen Strukturen. In vielen Fällen ist es nicht möglich, ein repräsentatives Volumenelement (RVE) zu definieren, da ein RVE in der Regel deutlich kleiner als die zu untersuchende Struktur und deutlich größer als das nächste kleinere Strukturelement sein sollte.
Zweitens könnte sich jede Änderung des mechanischen Verhaltens auf der Makroskala, aufgrund von Alter oder Krankheit, prinzipiell auf jeder Skala innerhalb der hierarchischen Struktur des Gewebes manifestieren. Daher wird die Beantwortung der Frage was sich nun genau in der Struktur oder Zusammensetzung verändert zu einer Herausforderung und erfordert Analysen auf mehreren bzw. allen Strukturebenen. Da dies im Allgemeinen nicht möglich ist, besteht der verbleibende gangbare Ansatz darin, eine fundierte Beurteilung der Hierarchieebene vorzunehmen, auf der die Änderungen erwartet werden, und auf dieser Ebene Experimente durchzuführen.
Im Forschungsbereich Biomechanik verfolgen wir eben diesen Ansatz, um einerseits die Mechanismen zu untersuchen, durch die das mechanische Verhalten gesunder biologischer Gewebe festgelegt wird, und andererseits welche Veränderungen aufgrund von Alterung und Krankheit auftreten können. Aufgrund der Tatsache, dass Zellen nur kleine Objekte „bauen“ können, erfordert dieser Ansatz auch die Fähigkeit, kleine Proben präparieren und zu charakterisieren, das heißt im Mikro- und Nanobereich. Zu diesem Zweck wurden und werden Miniaturprüfsysteme und spezifische Ansätze stetig weiterentwickelt, um so das mechanistische Verständnis der Gewebebiomechanik voranzutreiben. Die Forschung in diesem Bereich konzentriert sich auf die Veränderung der mechanischen Eigenschaften von hartem (Knochen) und weichem Gewebe in Abhängigkeit von Alter und Pathologie.